549 溶液如何配制和試劑如何選用?作者:馬清浩 一、一般溶液的配制 一般溶液是指非標準滴定溶液,它在分析工作中常作為溶解樣品,調節pH,分離或掩蔽離子,顯色等使用。配制一般溶液精度要求不高,溶液濃度只需保留1~2位有效數字,試劑的質量由托盤天平稱量,體積用量筒量取即可。 二、滴定分析用標準滴定溶液的配制 已知準確濃度的溶液叫做標準滴定溶液。標準滴定溶液濃度的準確度直接影響分析結果的準確度。因此,制備標準滴定溶液在方法、使用儀器、量具和試劑方面都有嚴格的要求。 (一)制備標準滴定溶液的基本要求 制備標準滴定溶液應按照GB/T601—2002《化學試劑標準滴定溶液的制備》,其規定如下: (1)制備標準滴定溶液用水,在未注明其他要求時,應符合GB/T6682—1992《分析實驗室用水規格和試驗方法》中三級水的規格。 (2)所用試劑的純度應在分析純以上。標定標準滴定溶液所用的基準試劑應為容量分析工作基準試劑。 (3)所用分析天平的砝碼、滴定管、容量瓶及移液管均需進行校正。 (4)制備標準滴定溶液的濃度系指20℃時的濃度,在標定和使用時,如溫度有差異,應按溫度補正值進行補正。 (5)“標定”或“比較”標準滴定溶液濃度時,平行試驗不得少于8次,兩人各做4次平行測定,每人4次平行測定結果的極差(即最大值和最小值之差)與平均值之比不大于0.1%。結果取平均值。濃度值取四位有效數字。 (6)對凡規定用“標定”和“比較”兩種方法測定濃度時,不得略去其中任何一種,且兩種方法測得的濃度值之差不得大于0.2%,以標定結果為準。 (7)制備的標準滴定溶液濃度與規定濃度相對誤差不得大于5%。 (8)配制濃度等于或低于0.02mol/L的標準滴定溶液時,應于臨用前將濃度高的標準滴定溶液用煮沸并冷卻的水稀釋。必要時重新標定。 (9)碘量法反應時,溶液的溫度不能過高,一般在15~20℃之間進行。 (10)滴定分析用標準滴定溶液在常溫(15~25℃)下,保存時間一般不得超過2個月。 (二)標準滴定溶液的制備方法 制備標準滴定溶液有直接配制法和標定法兩種方法。
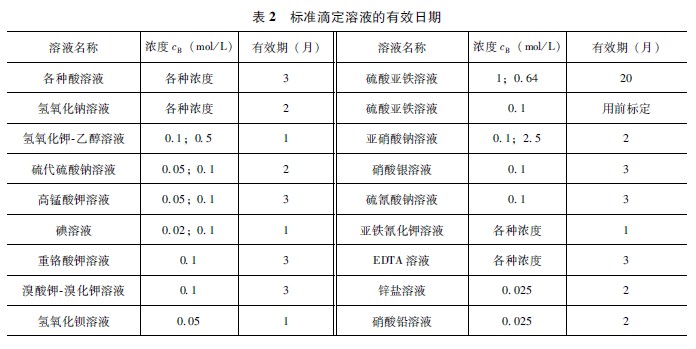
(1)直接配制法。在分析天平上準確稱取一定量已干燥的“基準物”溶于水后,轉入已校正的容量瓶中用水稀釋至刻度,搖勻,即可算出其準確濃度。常用的基準物見表1。 (2)標定法。很多物質不符合基準物的條件。例如,濃鹽酸中氯化氫很易揮發,固體氫氧化鈉易吸收水分和CO2,高錳酸鉀不易提純等。它們都不能直接配制標準滴定溶液。一般是先將這些物質配成近似所需濃度的溶液,再用基準物測定其準確濃度,這一操作叫做標定。標定的方法 有兩種: ①直接標定。準確稱取一定量的基準物,溶解于水后用待標定的溶液滴定至反應完全。根據 所消耗待標定溶液的體積和基準物的質量,計算出待標定溶液的準確濃度,計算公式為: c=mB/MBV (1) 式中c——待標定溶液的物質的量濃度,mol/L; mB——基準物的質量,g; MB——基準物的摩爾質量,g/mol; V——所消耗待標定溶液的體積,L。 例如標定HCl或H2SO4,可用基準物無水碳酸鈉。將無水碳酸鈉在270~300℃烘干至恒重,用不含CO2的水溶解,選用溴甲酚綠甲基紅混合指示劑指示終點。 ②間接標定。有一部分標準滴定溶液,沒有合適的用以標定的基準試劑,只能用另一已知濃度的標準滴定溶液來標定。如乙酸溶液可用NaOH標準滴定溶液標定,草酸溶液可用KMnO4標準滴定溶液標定等。當然,間接標定的系統誤差比直接標定要大些。 在實際工作中,除了上述兩種標定方法之外,還可以用“標準物質” 來標定標準滴定溶液。這樣做的目的,使標定與測定的條件基本相同,可以消除共存元素的影響,更符合實際情況。目前我國已有上千種標準物質出售。 用基準物直接標定標準滴定溶液的濃度后,為了更準確地保證其濃度,可采用比較法進行驗證。例如,HCl標準滴定溶液用無水碳酸鈉基準物標定后,再用NaOH標準滴定溶液進行標定。國家規定兩種標定結果之差不得大于0.2%, “比較” 既可檢驗HCl標準滴定溶液的濃度是否準確,也可考查NaOH標準滴定溶液的濃度是否可靠,最后以直接標定結果為準。 標準滴定溶液要定期標定,它的有效期要根據溶液的性質、存放條件和使用情況來確定。標準滴定溶液的有效日期見表2。
三、微量分析用離子標準溶液的配制 微量分析有比色法、原子吸收法等,所用的離子標準溶液,常用質量濃度表示,單位為mg/mL,ug/mL,g/L。配制時需用基準物或純度在分析純以上的高純試劑配制。濃度低于0.1mg/mL的標準溶液,常在臨用前用較濃的標準滴定溶液在容量瓶中稀釋而成。過稀的離子溶液,濃度易變,不宜長期存放。配制離子標準溶液可按式(2) 計算出所需純試劑的質量,溶解后在容量瓶中稀釋成一定體積,搖勻均可。
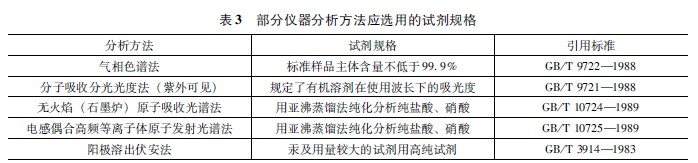
式中m——純試劑的質量,g; c——欲配離子標準溶液的質量濃度,mg/mL; V——欲配離子標準溶液的體積,mL; ?——換算系數。?=試劑中欲配組分的式量/試劑的式量。 四、溶液配制的注意事項 (1)分析實驗所用的溶液應用純水配制,容器應用純水洗滌三次以上,特殊要求的溶液應事先作純水的空白值檢驗。 (2) 溶液要用帶塞的試劑瓶盛裝,見光易分解的溶液要裝于棕色瓶中;揮發性試劑(如有機溶劑)配制的溶液,瓶塞要嚴密;見空氣易變質及放出腐蝕性氣體的溶液也要蓋緊,長期存放要用蠟封住;濃堿液應用塑料瓶裝,如裝在玻璃瓶中,要用橡皮塞塞緊,不能用玻璃磨口塞。 (3)每瓶試劑溶液必須有標明名稱、規格、濃度和配制日期的標簽。 (4)配制硫酸、磷酸、硝酸、鹽酸等溶液時,都應把酸倒入水中。對于溶解時放熱較多的試劑,不可試劑瓶中配制,以免炸裂。配制硫酸溶液時,應將濃硫酸分為小份慢慢倒入水中,邊加邊攪拌,必要時以冷水冷卻燒杯外壁。 (5)用有機溶劑配制溶液(如配制指示劑溶解)時,有時有機物溶解較慢,應不時攪拌,可以在熱水浴中溫熱溶液,不可直接加熱。易燃溶劑使用時要遠離明火。幾乎所有的有機溶劑都有毒,應在通風柜內操作。應避免有機溶劑不必要的蒸發,燒杯應加蓋。 (6)要熟悉一些常用溶液的配制方法。如碘溶液應將碘溶于較濃的碘化鉀水溶液中,才可稀釋。配制易水解的鹽類的水溶液應先加酸溶解后,再以一定濃度的稀酸稀釋。如配制SnCl2溶液時,如果操作不當已發生水解,加相當多的酸仍很難溶解沉淀。 (7)不能用手接觸腐蝕性及有劇毒的溶液。劇毒溶液應作解毒處理,不可直接倒入下水道。 五、化學試劑的選用 應根據不同的工作要求合理地選用相應級別的試劑。因為試劑的價格與其級別及純度關系很大,在滿足實驗要求的前提下,選用試劑的級別就低不就高。痕量分析要選用高純或優級純試劑,以降低空白值和避免雜質干擾。同時,對所用純水的制取方法和儀器的洗滌方法也應有特殊的要求。化學分析可使用分析純試劑。有些教學實驗,如酸堿滴定也可用化學純試劑代替。但配位滴定最好選用分析純試劑,因試劑中有些雜質金屬離子封閉指示劑,使終點難以觀察。 對分析結果準確度要求高的工作,如仲裁分析、進出口商品檢驗、試劑檢驗等,可選用優級純、分析純試劑。車間控制分析可選用分析純、化學純試劑。制備實驗、冷卻浴或加熱浴用的藥品可選用工業品。 表3是我國國家標準中提到的部分儀器分析方法要求使用的試劑規格。
化學試劑雖然都按國家標準檢驗,但不同制造廠或不同產地的化學試劑在性能上有時表現出某種差異。有時因原料不同,非控制項目的雜質會造成干擾或使實驗出現異常現象。故在做實驗時要注意產品廠家。另外,在標簽上都印有“批號”,不同批號的產品因其制備條件不同,性能也有所不同,在某些工作中,不同批號的試劑應用對照試驗。在選用紫外光譜用溶劑、液相色譜流動相、色譜載體、吸附劑、指示劑、有機顯色劑及試紙時,應注意試劑的生產廠家及批號并做好記錄,必要時應做專項檢驗和對照試驗。 應該指出,未經藥理檢驗的化學試劑是不能作為醫藥使用的。 |